
Aktuelle Empfehlungen bei Multipler Sklerose
In den letzten Jahren wurden vielfältige Erkenntnisse zur Therapie der Multiplen Sklerose (MS) gewonnen und das Spektrum der Behandlungsoptionen stark erweitert. Deshalb wurde die Leitlinie der Deutschen Gesellschaft für Neurologie (DGN) zur Diagnose und Therapie der MS aus dem Jahr 2012 nun überarbeitet und ergänzt.1 Im Folgenden werden die wichtigsten Therapieempfehlungen der aktuellen S2k-Leitlinie zusammengefasst.
Der Schwerpunkt der Empfehlungen in der neuen Leitlinie liegt auf der Behandlung der MS mit Medikamenten, die den Verlauf der MS modifizieren können (Disease Modifying Therapies, DMT).1 Dabei handelt es sich um Immuntherapien, die MS zwar nicht heilen, jedoch die Krankheitsaktivität reduzieren und die Lebensqualität erhalten können. Die Autoren der Leitlinie weisen darauf hin, dass die Effekte von Immuntherapeutika auf die entzündlichen Vorgänge prinzipiell umso größer sind, je früher diese im Krankheitsverlauf eingesetzt werden. Der klinische Nutzen ist somit am größten bei schubförmig verlaufender MS und nur noch gering bis marginal bei Patienten mit primär oder nicht aktiver sekundär progredienter MS.
Immuntherapie der schubförmig-remittierenden MS (RRMS)
Bei Patienten mit klinisch isoliertem Syndrom oder RRMS soll eine Immuntherapie begonnen werden. Ein Zuwarten kann unter engmaschiger Überwachung nach Diskussion mit dem Patienten erwogen werden, wenn von einem milden Verlauf ausgegangen werden kann.
Tab 1.: Wirksamkeitskategorien der Immuntherapeutika in der RRMS-Therapie
| Kategorie | Relative Reduktion der Schubrate vs. Placebo (%) | Wirkstoffe |
| 1 | 30–50 | Beta-Interferone inkl. Peg-
Interferon, Dimethylfumarat, Glatirameroide, Teriflunomid |
| 2 | 50–60 | Cladribin, Fingolimod,
Ozanimod |
| 3 | >60* | Alemtuzumab,
CD20-Antikörper, Natalizumab |
| *oder >40 Prozent gegenüber Wirkstoffen der Kategorie 1 | ||
Quelle: modifiziert nach Ref.1
Insbesondere soll unbehandelten Patienten mit RRMS eine Immuntherapie angeboten werden, wenn in einem Zeitraum von zwei vorausgegangenen Jahren mindestens ein klinisch objektivierbarer Schub oder Aktivität in der Magnetresonanztomographie (MRT) nachweisbar war. Argumente für das Einleiten einer Immuntherapie schon nach dem ersten Schub sind junges Lebensalter, ein polysymptomatischer Beginn, eine schlechte Rückbildung des Schubs, eine hohe Läsionslast, spinale/infratentorielle Läsionen und intrathekale Immunglobulinsynthese.
Die Immuntherapie der RRMS sollte sich nach der Aktivität der Erkrankung (gemessen an Schubfrequenz und -schwere, MRT-Befunden und Therapieansprechen) richten. Die Vielzahl der heute zugelassenen Immuntherapeutika erlaubt eine individuelle, nach Krankheitsaktivität und persönlichem Risikoprofil adaptierte Therapie (Treat-to-Target-Strategie).
Erstmals teilt die Leitlinie die Immuntherapeutika in drei Wirksamkeitskategorien in Abhängigkeit der in Studien beobachteten Reduktion der Schubraten ein, wobei diese Kategorien keine feste Zuordnung zu einer Therapiesequenz bedeuten (Tab.1). Diese Kategorisierung löst das alte Stufenschema ab.
Der empfohlene Therapiealgorithmus bei Ersteinstellung bzw. Eskalation der RRMS ist in Abb.1 zusammengefasst.
Wirkstoffwahl bei Therapie-naiven Patienten. Zu Beginn der Erkrankung sollten Wirkstoffe der Kategorie 1 eingesetzt werden, sofern kein hochaktiver Verlauf vorliegt. Grund sind die geringeren Sicherheitsrisiken in der Langzeitanwendung dieser Substanzen, insbesondere von Beta-Interferonen und Glatirameroiden. Die Wahl des Medikaments aus der Wirkstoffkategorie 1 soll sich in erster Linie nach den Nebenwirkungen und den Präferenzen und Komorbiditäten des Patienten richten.
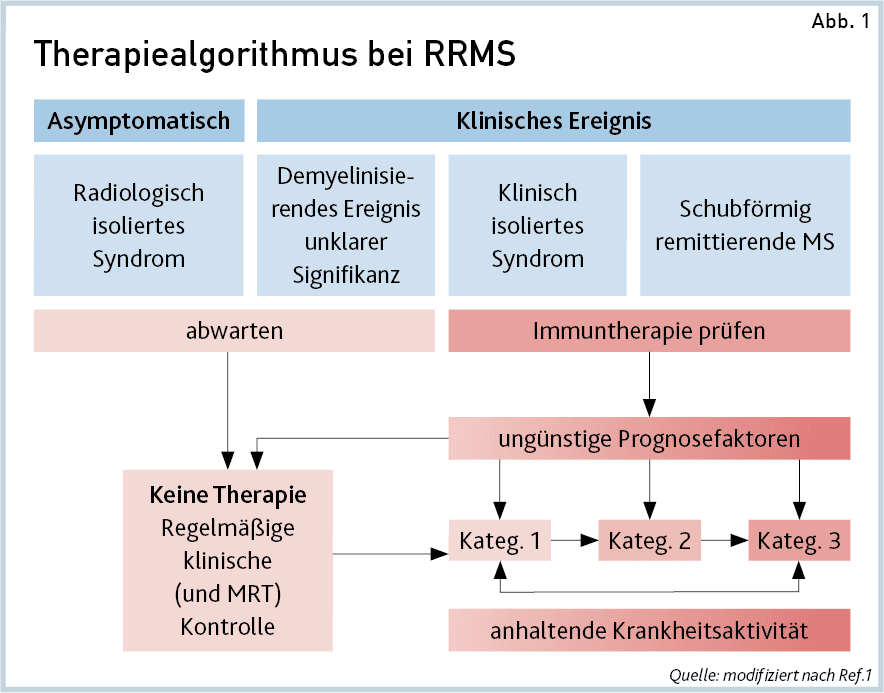
Wenn aber ein hochaktiver Verlauf wahrscheinlich ist, d.h. ungünstige Prognosefaktoren vorliegen, sollen Wirkstoffe der Kategorie 2 und 3 auch schon bei Therapie-naiven Patienten eingesetzt werden (je nach Substanz möglicherweise im Off-Label-Use; Abb.1). Solch ein hochaktiver Verlauf ist anzunehmen,
(a) wenn ein Schub trotz Therapie der Akutphase zu einem schweren Defizit geführt hat,
(b) bei schlechter Erholung von den ersten beiden Schüben,
(c) bei hoher Schubfrequenz,
(d) bei Erreichen eines EDSS ≥3,0 im ersten Jahr,
(e) bei Pyramidenbahnbeteiligung im ersten Krankheitsjahr.
Der primäre Einsatz hochaktiver Substanzen als Standard der Therapie bei allen Patienten in frühen Krankheitsphasen („hit hard and early“)2 wird von der Leitlinie aber kritisch bewertet.
Eskalation der RRMS-Therapie. Die Therapie ist bei Patienten zu intensivieren, die unter einer Therapie mit Substanzen der Wirksamkeitskategorie 1 einen entzündlich aktiven Verlauf haben. Solch ein Verlauf liegt vor, wenn unter einer Immuntherapie
(a) ≥1 klinisch eindeutig objektivierbarer Schub oder
(b) ein klinischer Schub und mindestens eine neue MS-typische Läsion in der MRT auftritt
(c) oder wenn bei schubfreien Patienten zu mindestens zwei Zeitpunkten ≥1 neue Läsion in der MRT in einen Zeitraum von bis zu zwei Jahren nachweisbar ist.
Die Leitlinie gibt spezifische Empfehlungen für die Wahl des Medikaments zur Eskalation:
- Je nach Ausmaß der Krankheitsaktivität soll ein Wechsel auf eine Substanz der Kategorie 2 oder 3 erfolgen. Ein Wechsel innerhalb der Substanzen der Kategorie 1 oder auf ein höher dosiertes Beta-Interferon sollte nur erwogen werden, wenn patientenindividuelle Gründe gegen einen Wechsel in die Kategorie 2/3 sprechen.
- Bei der Auswahl eines Medikaments aus der Kategorie 2 soll in Diskussion mit dem Patienten eine individuelle Nutzen-Risiko-Abwägung erfolgen.
- Bei der Auswahl eines Medikaments der Kategorie 3 soll bei JCV-Antikörper-seronegativen Patienten eine Abwägung zwischen Natalizumab und einem CD20-Antikörper erfolgen. Bei JCV-Antikörper-seropositiven Patienten, sollten CD20-Antikörper dagegen die Therapie der ersten Wahl sein.
- Alemtuzumab sollte nur noch zum Einsatz kommen, wenn eine Therapie mit Natalizumab oder CD20-Antikörpern nicht möglich ist und dies nur in erfahrenen Zentren.
Immuntherapie der primär progredienten MS (PPMS)
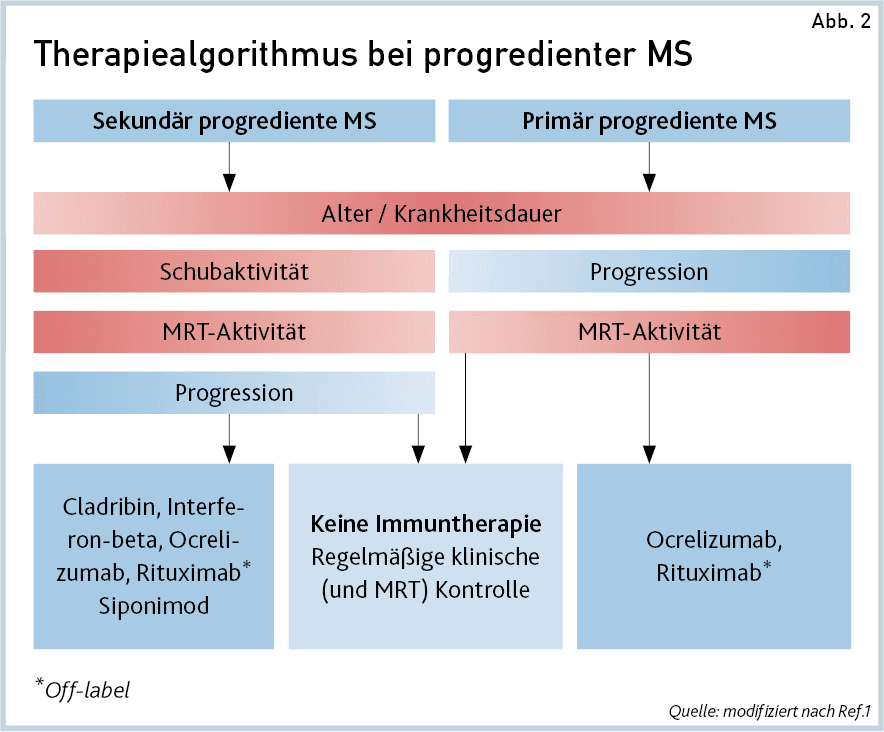
Dem empfohlenen Therapiealgorithmus bei progredienter MS (Abb.2) folgend sollen zur Behandlung der PPMS nach der aktuellen Studienlage nur CD20-Antikörper (Ocrelizumab und – im Off-Label-Use – Rituximab) eingesetzt werden.
Bei Patienten im Alter von ≥50 Jahren sollte die Indikation für CD20-Antikörper bei PPMS sehr streng gestellt werden, insbesondere beim Fehlen von entzündlicher MRT-Aktivität. Da Therapiealternativen fehlen, kann aber bei rascher Zunahme von Behinderung mit drohendem Verlust der Selbstständigkeit ein zunächst auf zwei Jahre begrenzter Therapieversuch erwogen werden.
Immuntherapie der sekundär progredienten MS (SPMS)
Bei Patienten mit schubförmiger MS, die im Verlauf in eine sekundär progrediente MS (SPMS) konvertieren, sollte die Indikation für eine Immuntherapie geprüft werden und eine Klassifizierung in aktive und nicht aktive SPMS erfolgen. Nach der aktuellen Studienlage stehen nur für die aktive SPMS, definiert durch den Nachweis von Schubaktivität oder neuen Läsionen in der MRT, wirksame Immuntherapeutika zur Verfügung.
Argumente für eine Immuntherapie sind junges Lebensalter, kurze Krankheitsdauer, geringer Behinderungsgrad, überlagerte Schübe oder rasche Zunahme der Behinderung und der Nachweis von entzündlicher Aktivität in der MRT. Bei aktiver SPMS kann der Einsatz von Siponimod, Beta-Interferonen, Cladribin und CD20-Antikörpern erwogen werden.
Bei nicht aktiver SPMS sollte keine Immuntherapie eingeleitet werden. Ähnlich wie bei der PPMS kann allerdings ein Therapieversuch mit CD20-Antikörpern unternommen werden.
Neue Medikamente in der Immuntherapie der MS
In den letzten Jahren konnte eine Reihe von Neuzulassungen das Behandlungsspektrum für verschiedene MS-Patientengruppen erweitern, wie in der Leitlinie ausführlich dargestellt wird. Dazu gehören drei Sphingosin-1-Phosphat (S1P)-Rezeptormodulatoren:
- Fingolimod ist seit Dezember 2018 auch für Jugendliche und Kinder ab zehn Jahren mit hochaktiver, schubförmiger MS zugelassen, die zuvor nur off-label behandelt werden konnten.
- Siponimod, ein selektiver S1P1- und S1P5-Rezeptor-Agonist, steht seit Januar 2020 als neue Therapieoption für Patienten mit SPMS mit aktivem oder hochaktivem Krankheitsverlauf, nachgewiesen durch Schübe und MRT-Aktivität, zur Verfügung. In der Studie EXPAND führte die Behandlung mit Siponimod zu einer signifikanten Reduktion des Risikos, eine Behinderung zu entwickeln (relative Risikoreduktion: 21%); es profitierten insbesondere die Patienten mit einer aktiven SPMS.3
- Ozanimod, ein weiterer selektiver S1P1- und S1P5-Rezeptor-Agonist, ist seit Mai 2020 zur Behandlung der aktiven RRMS zugelassen. Die Nebenwirkungen von Ozanimod entsprechen generell denen von Fingolimod. Lymphopenien, AV-Blockierungen und pathologische Leberenzyme sind aber nach derzeitiger Studienlage seltener.4 Es liegen bisher keine Primärdaten zur Wirksamkeit von Ozanimod bei Patienten mit SPMS vor.
Ocrelizumab war der erste für die Behandlung der MS zugelassene monoklonale Antikörper gegen CD20 (ein Antigen der B-Lymphozyten). Die Zulassung für RRMS basiert auf den Phase-III-Studien OPERA I und II, die eine signifikante Reduktion der Schubrate durch Ocrelizumab im Vergleich zu Interferon beta-1a zeigten.5 Ocrelizumab kann nicht nur zur Behandlung der RRMS eingesetzt werden, sondern stellt seit Februar 2018 auch die erste zugelassene Therapie der frühen PPMS dar. Diese Zulassung basiert auf der Phase-III-Studie ORATORIO; Ocrelizumab zeigte in dieser Studie einen gering ausgeprägten positiven Effekt auf die Behinderungsprogression. Subgruppenanalysen zeigten, dass jüngere Patienten (<45 Jahre) mit Kontrastmittel-anreichernden Läsionen am besten von der Therapie mit Ocrelizumab profitieren.6
Neben Ocrelizumab kann in der Behandlung der MS auch der Anti-CD20-Antikörper Rituximab im Off-Label-Use eingesetzt werden. Die Autoren der Leitlinie begründen diese Empfehlung damit, dass die klinische Evaluation von Ocrelizumab eindeutig auf Vorbefunden mit Rituximab beruht. Auch hinsichtlich der wesentlichen pharmakologischen Eigenschaften seien die beiden Antikörper „quasi identisch“ und große Kohortenstudien belegen die langfristige Wirksamkeit von Rituximab in der MS-Therapie.
Ofatumumab, ein dritter Anti-CD20-Antikörper, wurde im März 2021 für die Behandlung der RRMS zugelassen. Die Leitlinie verweist auf die in den Phase-III-Studien ASCLEPIOS I und II gegenüber Teriflunomid demonstrierte Überlegenheit von Ofatumumab mit einer signifikanten Reduktion der Schubrate.5 Aufgrund des Redaktionsschlusses der Leitlinie (Feb. 2021) fand Ofatumumab aber noch keine Aufnahme in die Therapieempfehlungen.
Auch für schubförmige Erkrankungen des Neuromyelitis-optica-Spektrums (NMOSD), die früher als eine Subgruppe der MS eingeordnet wurden, wurde erstmals ein Medikament zugelassen: Eculizumab, ein rekombinanter humanisierter monoklonaler Antikörper, steht seit August 2019 zur Therapie der Aquaporin-4-Anti- körper-positiven NMOSD mit schubförmigem Krankheitsverlauf zur Verfügung.
Therapiedauer und Therapieende
Als wesentliche Neuerung schlägt die Leitlinie für die einzelnen Wirksamkeitskategorien Einstiegs-, Wechsel- und auch Ausstiegsszenarien vor. Bei Patienten, die vor Einleiten der Immuntherapie eine geringe Krankheitsaktivität aufwiesen und unter der Therapie mit einem Medikament der Wirksamkeitskategorie 1 keine Krankheitsaktivität zeigen, kann bei Patientenwunsch nach einem Zeitraum von mindestens fünf Jahren das Absetzen bzw. eine Pause der Immuntherapie in Betracht gezogen werden. Die Patienten sollten darüber aufgeklärt werden, dass der Zeitraum von fünf Jahren nicht evidenzbasiert ist und es keine kontrollierten Studien gibt, mit denen das Krankheitsrisiko nach dem Absetzen zuverlässig eingeschätzt werden kann.
Bei Alemtuzumab und Cladribin ist die Therapie grundsätzlich auf maximal vier (Alemtuzumab) bzw. zwei Therapiezyklen (Cladribin) begrenzt. Liegt nach einer Behandlung mit Alemtuzumab und Cladribin keine Krankheitsaktivität vor, sollte zunächst keine andere Immuntherapie begonnen werden. Der Verlauf sollte jedoch regelmäßig durch klinische und bildgebende Untersuchungen kontrolliert werden.
Die Therapiedauer bei Patienten ohne Krankheitsaktivität unter S1P-Modulatoren, Natalizumab oder CD20-Antikörpern sollte individuell festgelegt werden, da hierzu bisher keine Studien vorliegen. Beim Absetzen bzw. bei der Umstellung von Fingolimod und Natalizumab auf Alternativsubstanzen ist besondere Vorsicht geboten, da bei diesen häufig ein frühes Wiederaufflammen von entzündlicher Aktivität beobachtet wurde. Solche Rebound-Effekte sind auch für die neueren S1P-Modulatoren (Ozanimod, Siponimod) nicht auszuschließen.
Immuntherapie bei älteren Patienten, Kindern und Jugendlichen
Ein wichtiger Parameter für die Wirksamkeit von Immuntherapeutika stellt das Alter der Patienten dar. Metaanalysen haben ergeben, dass die Wirksamkeit mit zunehmendem Alter abnimmt, während sich bei Kindern und jungen Erwachsenen stärkere Effekte der Immuntherapeutika zeigen.1 Die Leitlinie gibt deshalb erstmals Empfehlungen zu Besonderheiten bei der Behandlung von Älteren und Jüngeren.
Bei fünf bis zehn Prozent der Patienten manifestiert sich die MS nach dem 50. Lebensjahr. Allein der Umstand eines höheren Alters bei Erstmanifestation stellt gemäß der Leitlinie keinen Hinderungsgrund für das Einleiten einer Immuntherapie sein. Bei einer Immuntherapie im höheren Alter (>55 Jahre) sollte aufgrund einer altersbedingt veränderten Pharmakokinetik und -dynamik von Medikamenten besonders auf Unverträglichkeiten und Nebenwirkungen geachtet werden und eine engmaschige Überwachung erfolgen. Insbesondere soll auch auf zusätzliche kardiovaskuläre Risikofaktoren geachtet werden.
Bei drei bis sieben Prozent aller MS-Patienten tritt die Erkrankung vor dem 18. Lebensjahr auf. Die Therapie eines akuten Schubs bei Kindern soll wie bei Erwachsenen erfolgen (Methylprednisolon, gewichtsadaptiert dosiert). Eine Immuntherapie soll bei leichtem/mittelschwerem Verlauf mit einem Beta-Interferon-Präparat oder einem Glatirameroid erfolgen; bei aktivem Krankheitsverlauf soll bei über Zehnjährigen auf Fingolimod gewechselt werden. Fingolimod stellt bei schweren Verlaufsformen auch die Primärtherapie dar.
MS-Therapie bei Kinderwunsch, während der Schwangerschaft und Stillzeit
MS-Patientinnen sollten über die Therapieoptionen vor, während und nach einer Schwangerschaft (SWS) beraten werden. Detaillierte Empfehlungen dazu wurden in die Leitlinie aufgenommen bzw. aktualisiert:
- Bei Kinderwunsch sollte die Therapie mit Beta-Interferonen und Glatirameroiden bis zur Bestätigung der SWS beibehalten werden. Auch kann eine Therapie mit Dimethylfumarat bis zum Eintritt der SWS erwogen werden. Dagegen kann Natalizumab nur in Einzelfällen nach strenger Risiko-Nutzen-Abwägung bis zum Beginn einer SWS eingesetzt werden. Alle anderen Medikamente zur MS-Immuntherapie sollten bei Kinderwunsch nicht begonnen werden bzw. müssen rechtzeitig abgesetzt werden.
- Bei Auftreten eines Schubs während der SWS, kann nach dem ersten Trimenon eine Therapie mit hochdosierten Glukokortikosteroiden erfolgen, in Ausnahmefällen (z.B. sehr schwerer Schub) auch im ersten Trimenon. Immuntherapien werden bei SWS in der Regel abgesetzt. Nur Beta-Interferone und Glatirameroide können gemäß der Leitlinie nach Risiko-Nutzen-Abwägung bei Frauen mit hoher Krankheitsaktivität während der SWS fortgeführt werden, und in Einzelfällen auch die Therapie mit Natalizumab. Streng kontraindiziert während der SWS sind Teriflunomid, S1P-Rezeptor-Modulatoren und Cladribin.
- Während der Stillzeit sind unter den Immuntherapeutika nur Beta-Interferone zugelassen. Gemäß der Leitlinie kann der Einsatz von Beta-Interferonen und Glatirameroiden nach einer Risiko-Nutzen-Abwägung erwogen werden.
Referenzen
- Hemmer B et al.: Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG- assoziierten Erkrankungen, S2k-Leitlinie, 2021, in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. Online: www.dgn.org/leitlinien (abgerufen am 15.8.2021)
- Stankiewicz JM & Weiner HL: An argument for broad use of high efficacy treatments in early multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2019; 7:e636
- Kappos L et al.: Siponimod versus Plazebo in secondary progressive multiple sclerosis (EXPAND): a double-blind, randomised, phase 3 study. Lancet 2018; 391:1263–73
- Swallow E et al.: Comparative safety and efficacy of ozanimod versus fingolimod for relapsing multiple sclerosis. J Comp Eff Res 2020; 9:275–85
- Hauser SL et al.: Ocrelizumab versus interferon beta-1a in relapsing multiple sclerosis. N Engl J Med 2017; 376:221–34
- Montalban X et al.: Ocrelizumab versus placebo in primary progressive multiple sclerosis. N Engl J Med 2017; 376:209–20
- Hauser S L et al.: ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus teriflunomide in multiple sclerosis. N Engl J Med 2020; 383:546–57