EMA & NIG empfehlen Kinder-Vakzin, Vials sollen schon früher kommen
Am 25. November 2021 gab die Europäische Arzneimittelbehörde EMA grünes Licht für die Impfung von Kindern ab fünf Jahren mit einer eigenen Formulierung von BioNTech/Pfizer gegen SARS-CoV-2. Das Nationale Impfgremium zog noch am selben Tag nach – samt Anleitung der Dritteldosierung aus den Erwachsenen-Vials. Laut der Deutschen Presse Agentur (dpa) will der Hersteller die Kinder-Formulierung für die EU-Länder schon am 13. Dezember ausliefern, um eine Woche früher. Die EMA betonte außerdem bei ihrem Meeting erneut die Wichtigkeit der dritten Dosis und informierte über andere Impfstoffe sowie über COVID-19-Therapeutika.
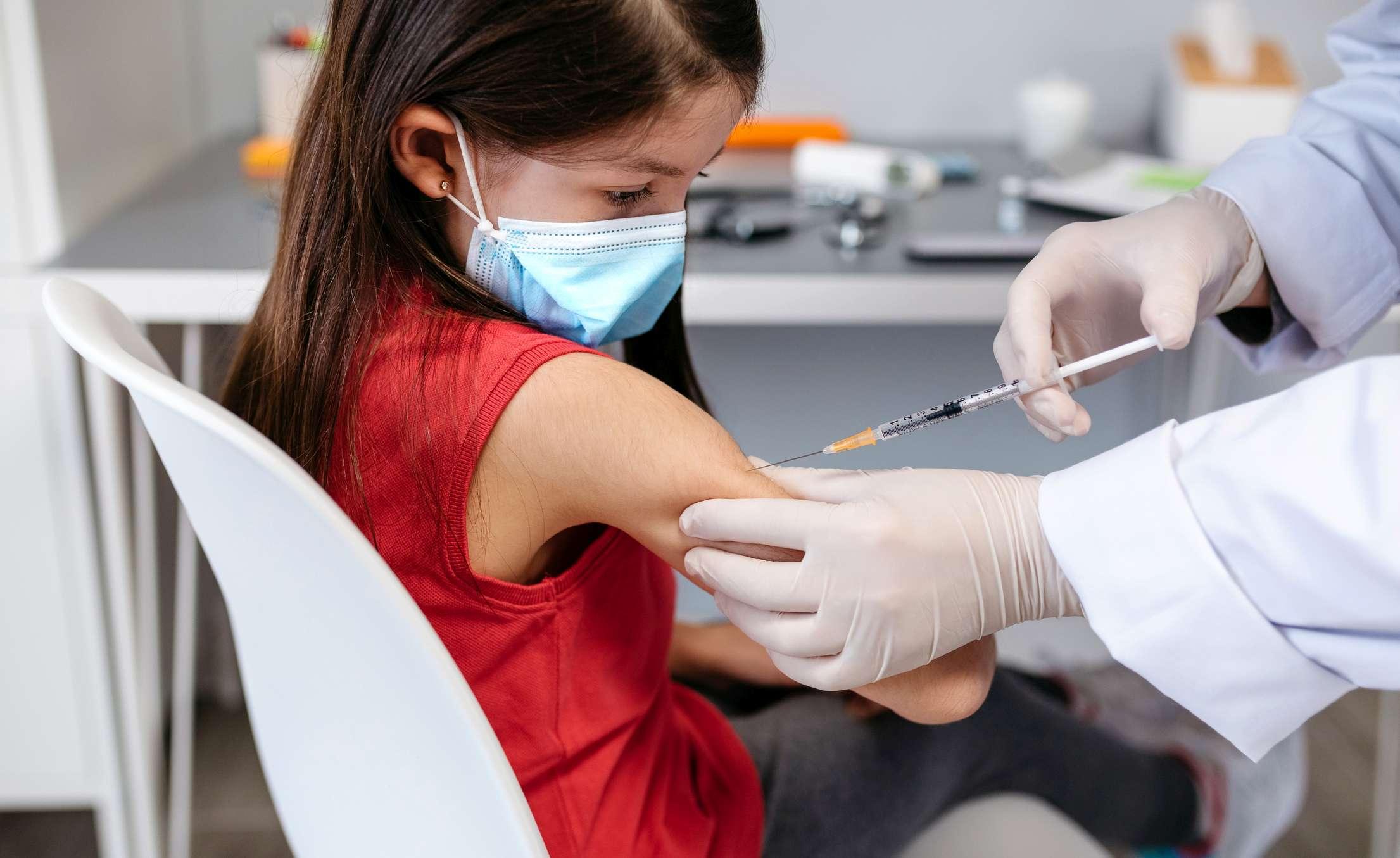
„Die Kinderimpfung ist sicher“, wiederholte Gesundheitsminister Dr. Wolfgang Mückstein (Grüne) in der anschließenden Pressekonferenz mit NIG-Leiterin Univ.-Prof. Dr. Ursula Wiedermann-Schmidt die Botschaft der EMA. Da es aber für die Kinder-Formulierung eigene Vials gibt – 258.000 Dosen (zwei Prozent von insgesamt zugesagten 13 Millionen Dosen im Jahr 2021) sollen bis Jahresende nach Österreich geliefert werden – stellte das NIG auch gleich eine Anleitung1 ins Netz, wie aus den Erwachsenen-Vials eine Dritteldosis für Kinder aufgezogen werden kann.
Diese Anleitung wird jetzt schon fleißig verwendet und könnte trotz eines eventuell vorgezogenen Lieferstarts weiter nützlich bleiben: Denn für knapp 600.000 Kinder im Alter von fünf bis elf Jahren reichen 258.000 Dosen bei Weitem nicht – sofern entsprechende Impfkampagnen auf Interesse stoßen. Hier können sich die Länder ebenfalls Tipps von der EMA holen, eine eigene Präsentation widmete sich den kursierenden Fehlinformationen2 über COVID-19-Impfstoffe.
Cooke: „The pandemic is clearly not over“
Doch der Reihe nach. Es gebe „keinen Zweifel“, die Impfstoffe gegen COVID-19 seien ein „Schlüsselinstrument“ und würden Tausende Krankheitsfälle und Tote verhindern, leitet EMA-Direktorin Emer Cooke das virtuelle Meeting am 25.11.2021 ein. Aber Impfstoffe alleine reichten nicht aus, es seien auch Public-Health-Maßnahmen nötig. Als solche nennt die irische Pharmazeutin Social Distancing, Masken, Hygienemaßnahmen wie Händewaschen und Home Office. „Die Pandemie ist ganz klar nicht vorbei“, hebt Cooke hervor, aber es sei „Zeit für Hoffnung“. Etwas mehr als drei Viertel (77 Prozent) der EU-Bevölkerung ab 18 Jahren bzw. rund zwei Drittel der Gesamtbevölkerung3 sind geimpft.
Booster holen, um Impfschutz wieder herzustellen
Dr. Marco Cavaleri, Leiter der EMA-Abteilung Biologische Gesundheitsgefahren und Impfstrategien, betont, auch bei der Delta-Variante – dass die Omikron-Variante bereits zu diesem Zeitpunkt in Europa grassiert, wurde erst wenige Tage später bekannt – seien die Impfstoffe effektiv. Aber es gebe nach wie vor genug zu tun, da die Infektions- und Hospitalisierungszahlen in Europa steigen. „Die meisten Hospitalisierungen und Todesfälle gibt es bei ungeimpften Menschen, aber einige sind auch geimpft“, verweist Cavaleri auf vorhandene Evidenz, dass der Schutz mit der Zeit schwinde. „Das ist nicht unerwartet, weshalb die Menschen ihren Schutz mit einem Booster wieder herstellen sollen.“
Die Daten zeigten, dass der Schutz gegen „Infektion und Erkrankung“ wieder gegeben sei und der Booster „hohe Antikörper-Level“ verleihe. Die meisten Staaten würden bereits Booster verabreichen. Die EMA empfiehlt Booster ab 6 Monate nach Comirnaty und Spikevax nach der zweiten Dosis bei Erwachsenen sowie nach Janssen ab 2 Monate nach der ersten Dosis bei Erwachsenen (ebenfalls abweichende NIG-Empfehlungen1). Eine „extra Dosis“ von Comirnaty und Spikevax soll es für stark Immungeschwächte ab 12 Jahren geben.
Booster bisher gut vertragen, hohe Antikörper-Level
Die Nebenwirkungen des Boosters sind laut Cavaleri ähnlich wie bei der zweiten Dosis von Comirnaty und Spikevax3. Trotz einer steigenden Anzahl von Menschen, die Booster erhalten haben, wurden bisher keine spezifischen Sicherheitsrisiken identifiziert3. „Das Risiko von Myokarditis/Perikarditis3 und anderen sehr seltenen Nebenwirkungen nach Booster wird sorgfältig überwacht“, sagt Cavaleri.
Ein heterologes Impfschema („mix-and-match vaccination“), das von mehreren EU-Staaten verabreicht werde, zeige eine gute Immunantwort und eine relevante Schutzwirkung. Auch ein heterologes Boostern (z.B. Comirnaty auf Spikevax oder vice versa) führt Studien zufolge zu einer guten Immunantwort. Die EMA bereitet entsprechende Empfehlungen vor, informiert Cavaleri.
Die meisten pädiatrischen COVID-Hospitalisierungen betreffen gesunde Kinder
Zur Kinderimpfung betont er, dass schwere COVID-19-Erkrankungen und Todesfälle bei Kindern selten seien, aber Erkrankungen aller Schweregrade weiterhin auftreten:
- Hohe Ansteckungszahlen ziehen steigende Hospitalisierungen von Kindern jeden Alters nach sich.
- Obwohl Kinder mit Vorerkrankungen vulnerabler sind, stellen gesunde Kinder die meisten pädiatrischen Hospitalisierungen in der EU dar.
- Nach COVID-19 können Kinder am multisystemischen Inflammationssyndrom (MIS-C) leiden. Dieses kann so schwer sein, dass bis zu 70 Prozent der Fälle intensivpflichtig werden.
- Kinder können auch Langzeit-Folgen von COVID-19 ausgeliefert sein, die derzeit noch nicht absehbar sind.
Für Kinder ab 12 Jahren sind Comirnaty und Spikevax zugelassen (abweichende NIG-Empfehlungen1), für jüngere Kinder (5–11a) einstweilen nur Comirnaty. Spikevax wird derzeit für Kinder im Alter von 6–12 Jahren geprüft.
Cavaleri betont weiters, dass COVID-19 besonders für Schwangere gefährlich sein kann. Die mRNA-Vakzine hätten effektiv COVID-19 vorgebeugt, „Studien zur Sicherheit von mRNA-Impfstoffen während der Schwangerschaft haben keine Sicherheitsbedenken gezeigt“.
Notfallzulassung für Comirnaty, Spikevax und Vaxzevria um ein Jahr verlängert
Derzeit sind für die Verwendung in der EU die vier Impfstoffe Comirnaty, Spikevax (vormals Moderna), Vaxzevria (vormals AstraZeneca) und COVID-19-Vakzin Janssen zugelassen. Die EMA hat kürzlich die Notfallzulassung bzw. die sogenannte CMA (Conditional Marketing Authorisation) für Spikevax, Comirnaty und Vaxzevria für ein weiteres Jahr erteilt. Folgende Impfstoffe befinden sich weiterhin im Rolling Review (Daten werden laufend geprüft, Start des Reviews in Klammer):
- Sputnik V (Gam-COVID-Vac, 4. März 2021), Hersteller: Gamaleya National Centre of Epidemiology and Microbiology
- COVID-19 Vaccine (Vero Cell) Inactivated (4. Mai 2021): Sinovac Life Sciences
- Vidprevtyn (20. Juli 2021): Sanofi Pasteur
Erster proteinbasierter Impfstoff in der letzten Prüfrunde
Der Hersteller Novavax hat für seinen Impfstoffkandidaten Nuvaxovid (NVX-CoV2373) den Zulassungsantrag eingereicht, der Start der endgültigen Prüfung nach dem Rolling Review war am 17.11.2021. Bei Nuvaxovid handelt es sich um den ersten proteinbasierten Impfstoff, der für die Marktzulassung geprüft wird. Der Impfstoff enthält winzige Partikel aus einer im Labor gezüchteten Version des Spike(S)-Proteins von SARS-CoV-2 sowie ein Adjuvans, um die Immunantwort zu verstärken.
Medikamente immer „zusätzliches Tool“
Neben den Impfungen sprach Cavaleri auch Medikamente zur Therapie von COVID-19 an. Diese sollen aber im Kampf gegen COVID-19 die Impfungen nicht ersetzen, sondern nur ergänzen – als „zusätzliches Tool“, um die Krankheitslast zu senken (siehe Kasten). „Therapeutika sind besonders relevant für vulnerable Gruppen und Menschen, die keine ausreichende Immunantwort auf die Impfung haben“, sagt Cavaleri.
Grundsätzlich werden zwei Ansätze unterschieden, biologische Arzneimittel und chemische Arzneimittel. Zu Ersteren zählen neutralisierende monoklonale Antikörper. Sie bestehen aus Proteinen, die sich an das Virus anlagern und es daran hindern, in die Körperzellen einzudringen. Andere wirken als immunmodulatorische Mittel, sie reduzieren die Aktivität des körpereigenen Immunsystems und verringern Entzündungen und Atemstillstand.
Zu den chemischen Medikamenten wiederum zählen antivirale Enzym- oder Polymerasehemmer. Sie blockieren Zellprozesse, die die Vermehrung des Virus in den Zellen verhindern bzw. stören können. „Einige wirken als immunmodulatorische Wirkstoffe und helfen dabei, abnormale Immunantworten zu stabilisieren“, erklärt Cavaleri, bevor er auf die einzelnen Medikamente eingeht (siehe Kasten).
Für zwei Arzneimittel bereits Empfehlung vor der Zulassung
Zu den zwei Therapeutika Lagevrio (Molnupiravir) und Paxlovid (von Pfizer) ergänzt er: Während ein umfassenderer Rolling Review laufe, habe die EMA bereits eine Empfehlung zur Anwendung von Lagevrio (Molnupiravir) zur Behandlung von COVID-19 bei Erwachsenen gegeben, die keinen zusätzlichen Sauerstoff benötigen und ein erhöhtes Risiko für schweres COVID-19 haben. Die EMA überprüfe auch derzeit verfügbare Daten zur Anwendung von Paxlovid zur Behandlung von COVID-19.
„Diese Überprüfungen werden die nationalen Behörden unterstützen, die über eine frühzeitige Anwendung dieser Behandlungen, beispielsweise in Notfallsituationen, vor der Zulassung für das Inverkehrbringen entscheiden können“, sagt Cavaleri.
Abschließend betont er erneut, dass sichere und effektive Medikamente die Impfungen nicht ersetzen: „Die EU-Bürger werden ermutigt, sich impfen zu lassen und die von den Behörden empfohlenen Maßnahmen im Bereich der öffentlichen Gesundheit zu befolgen, um sich selbst zu schützen und die Infektionsraten niedrig zu halten.“
Referenzen:
- https://www.sozialministerium.at/dam/jcr:de8b7875-5577-44af-8d8f-ea68a2895957/COVID-19-Impfung_Empfehlung_zu_Comirnaty_Kinder_5_bis_11_Jahre__Version_1_(Stand__25.11.pdf
Via: https://www.sozialministerium.at/Corona-Schutzimpfung/Corona-Schutzimpfung---Fachinformationen.html - https://www.ema.europa.eu/documents/presentation/presentation-addressing-misinformation-covid-19-vaccines-m-carr-ema_en.pdf
- https://www.ema.europa.eu/documents/presentation/presentation-covid-19-surveillance-vaccination-coverage-eu-p-kramarz-ecdc_en.pdf
Via: https://www.ema.europa.eu/en/events/public-stakeholder-meeting-covid-19-vaccines-therapeutics-eu#event-summary-section
Überblick über COVID-19-Therapeutika
Derzeit befinden sich im Rolling Review:
- Evusheld (Tixagevimab/Cilgavimab)
Der Zulassungsantrag wurde eingereicht für:
- Kineret (Anakinra)*
- Lagevrio (Molnupiravir)
- Olumiant (Baricitinib)*
- RoActemra (Tocilizumab)*
- Xevudy (Sotrovimab)
Empfehlung für Mitgliedstaaten über Behandlungen, die bisher nicht spezifisch für COVID-19-Patienten zugelassen sind:
- Bamlanivimab/Etesevimab
- Casirivimab/Imdevimab
- Dexamethason
- Lagevrio (Molnupiravir)
- Regdanvimab
- Sotrovimab
Folgende drei Therapeutika sind in der EU zugelassen:
- Veklury (Remdesivir): für die Behandlung von COVID-19-Patienten ab 12 Jahren mit Pneumonie, die zusätzlichen Sauerstoff benötigen
- Regkirona (Regdanvimab): zugelassen für die Behandlung von Erwachsenen mit erhöhtem Risiko für einen schweren Verlauf
- Ronapreve (Casirivimab/Imdevimab): zugelassen für die Prävention von COVID-19 ab 12 Jahren und die Behandlung erkrankter Patienten ab 12 Jahren mit erhöhtem Risiko für einen schweren Verlauf
*Diese Medikamente sind bereits für andere Indikationen zugelassen. Weitere Infos: COVID-19 treatments | European Medicines Agency (europa.eu)
