Molekularer Mechanismus der TNF-α-Aktivierung
Kieler Forscher deckten einen grundlegend neuen Mechanismus der Regulation von Botenstoffen bei Entzündungen auf.

Hemmstoffe, die von Bedeutung für Entzündungskrankheiten sind.
Mit ihren Kollegen entdeckten sie, auf welchem molekularen
Mechanismus die Aktivierung des Tumornekrosefaktors-alpha basiert.
Eine Arbeitsgruppe des Exzellenzclusters Entzündungsforschung an der Medizinischen Fakultät der Christian-Albrechts-Universität zu Kiel (CAU) konnte klären, auf welchem molekularen Mechanismus die Freisetzung und damit Aktivierung des Tumornekrosefaktors-alpha (TNF-α) basiert. Ihre kürzlich im Fachmagazin Nature Communications publizierte Studie liefert neue Ansatzpunkte für die Entwicklung antiinflammatorischer Therapien.
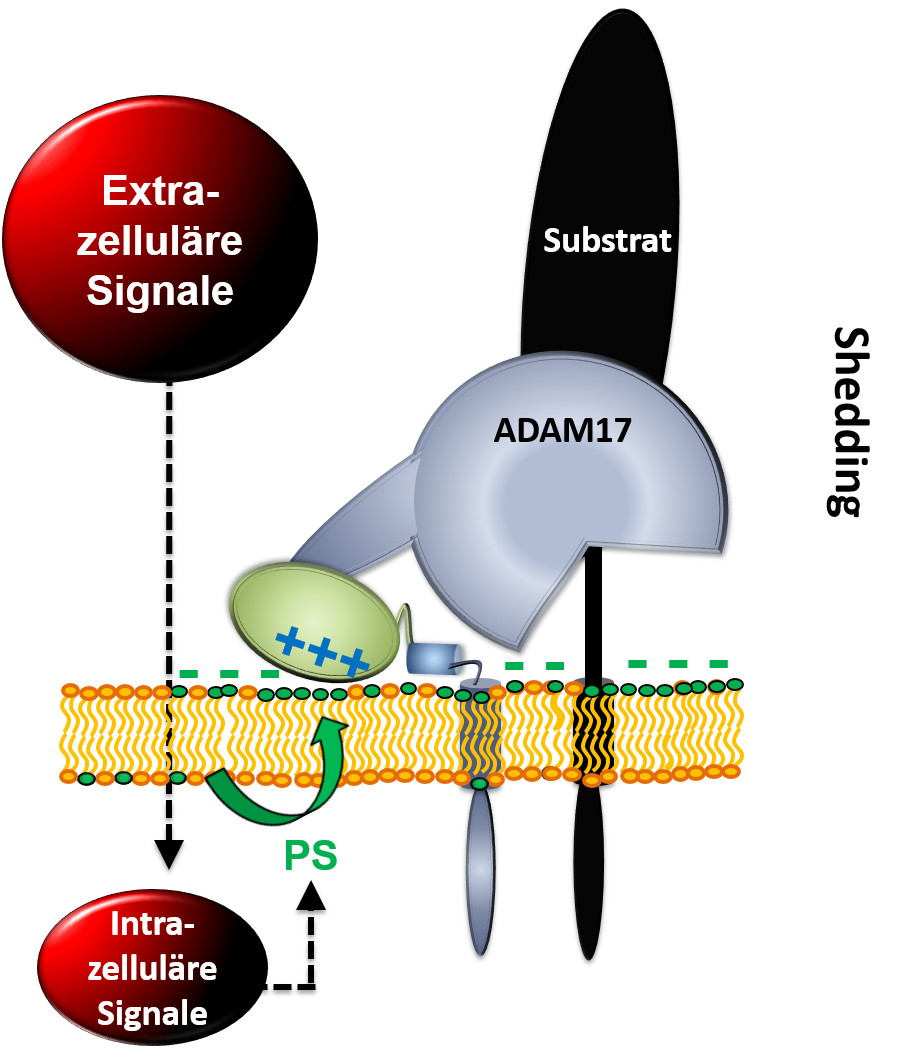
ADAM17 aus der Familie der Disintegrin- und Metalloproteinase-Familie (ADAM) kontrolliert durch die Spaltung von Transmembransubstraten die vitalen Zellfunktionen. Die Kieler Foscher präsentieren in ihrer Forschungsarbeit Beweise, dass die Exposition der Oberfläche des Lipidmoleküls Phosphatidylserin (PS) von zentraler Bedeutung dafür ist, dass ADAM17 die Sheddaseaktivität ausüben kann. In verschiedenen Zellmodellen korreliert nämlich die ADAM17 Sheddaseaktivität mit der PS-Exposition.
Mit Substanzen, von denen bekannt ist, dass sie ADAM17 aktivieren, konnte der Mechanismus in Zellkulturstudien nachgewiesen werden. Zudem wurde jendr Bereich des ADAM17-Moleküls identifiziert, welcher mit negativen Ladungen von PS interagiert.
“Wir haben beobachtet, dass das negativ geladene Phosphatidylserin unter bestimmten Umständen kurzfristig nach außen kommt, also quasi umklappt. Dadurch entsteht außen eine negative Ladung. ADAM17 hat positive Ladungen, die mit dieser negativen Ladung interagieren. Das ist der entscheidende Mechanismus, der die Protease aktiviert, damit sie etwas abschneidet.” Anselm Sommer
Den Kieler Forschern zufolge sei es möglich, dass nicht nur die Protease ADAM17, sondern auch andere Proteine durch dieses nach außen Drehen von PS in ihrer Funktion beeinflusst werden. Nun soll das neu entdeckte Prinzip am Mausmodell nachgewiesen werden.
Phosphatidylserine exposure is required for ADAM17 sheddase function:
https://youtu.be/iEusE-pDmhk
Anselm Sommer, Felix Kordowski, Joscha Büch, Thorsten Maretzky, Astrid Evers, Jörg Andrä, Stefan Düsterhöft, Matthias Michalek, Inken Lorenzen, Prasath Somasundaram, Andreas Tholey, Frank D. Sönnichsen, Karl Kunzelmann, Lena Heinbockel, Christian Nehls, Thomas Gutsmann, Joachim Grötzinger, Sucharit Bhakdi, Karina Reiss
Phosphatidylserine exposure is required for ADAM17 sheddase function
Nature Communications, Published 10 May 2016, doi: 10.1038/ncomms11523
Quelle: Christian-Albrechts-Universität zu Kiel, Ezellenzcluster Entzündungsforschung