Myokarditis hat viele Gesichter
Die akute Myokarditis ist hinsichtlich klinischer Manifestation und Krankheitsschwere eine heterogene Erkrankung. Deshalb empfiehlt sich für die Diagnostik ein flexibles mehrstufiges Prozedere, das verschiedene kardiologische Aspekte berücksichtigt.
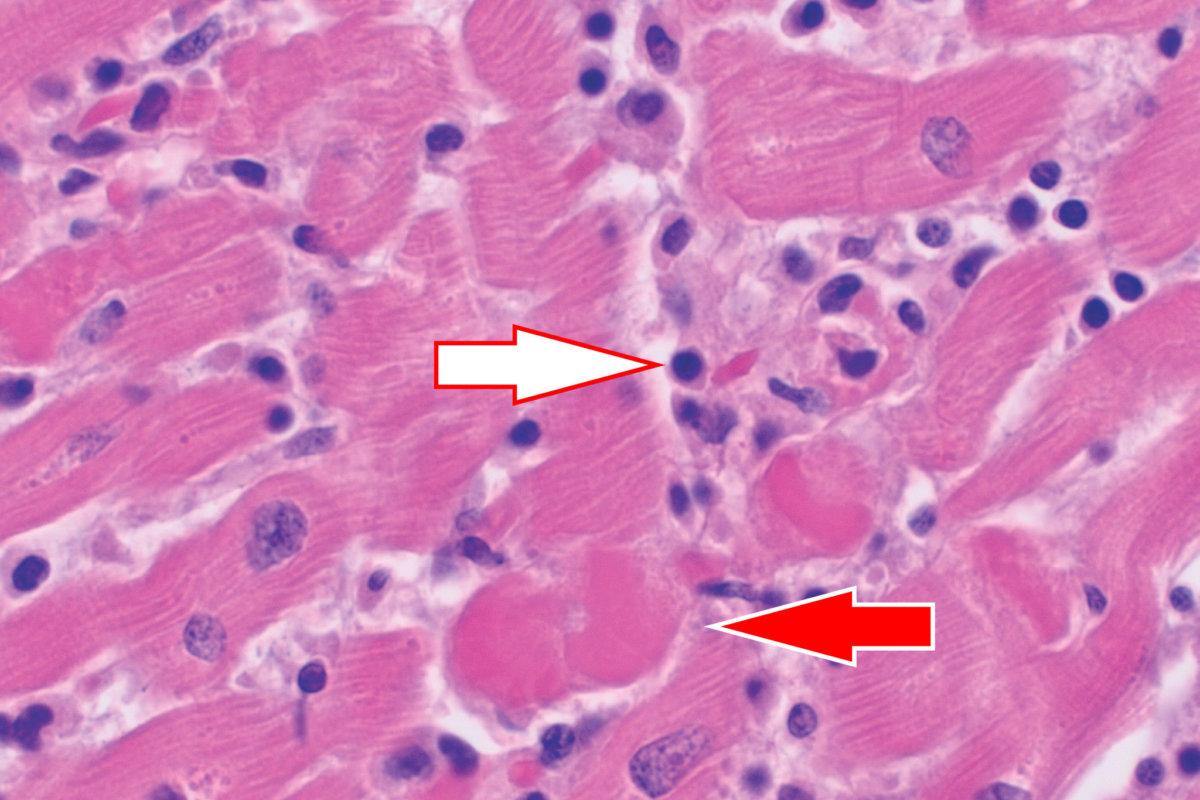
Eine Myokarditis ist eine immunvermittelte inflammatorische Reaktion des Myokards auf infektiöse oder nichtinfektiöse Trigger verschiedener Art, darunter Viren, Bakterien, Pilze, Toxine und bestimmte Medikamente. Bei fortbestehender Entzündung kann es zur Vernarbung kommen, was maligne Arrhythmien und eine kardiale Dysfunktion begünstigt. In etwa 30 % der Fälle einer bioptisch bestätigten Myokarditis entwickelt sich eine chronische inflammatorische Kardiomyopathie.
Die Erkrankung macht sich meist bemerkbar durch eine plötzlich auftretende moderate bis schwere Herzinsuffizienz. Weniger typische Manifestationen sind keineswegs selten und können auf eine falsche Fährte locken, schreiben Dr. Pieter Martensund Koautoren von der Cleveland Clinic. So steckt hinter jedem dritten Myokardinfarkt mit unauffälligen Koronararterien eine Myokarditis. Bei ventrikulären Arrhythmien, für die man keine andere Ursache findet, trifft dies auf bis zu 51 % der Fälle zu.
Genetische Testung in Einzelfällen sinnvoll
Wenn sich aus einer akuten Myokarditis eine linksventrikuläre Dysfunktion entwickelt, können pathogene Mutationen in desmosomalen oder mit Kardiomyopathie assoziierten Genen vorliegen. Das trifft auf 15 % bzw. 30 % der Patienten zu. Eine genetische Testung kann in Einzelfällen sinnvoll sein.
Die Autoren empfehlen für die Diagnose ein flexibles mehrstufiges Vorgehen. Dies ermöglicht es, in einem ersten Schritt spezifische Krankheitsursachen mit eigenen therapeutischen Konsequenzen zu erkennen (z.B. Sarkoidose, Riesenzell-Myokarditis, Lyme-Karditis), das Risiko für eine Chronifizierung einzuschätzen und das Ausmaß des Myokardschadens zu erfassen. Zum initialen Programm gehören Anamnese, körperliche Untersuchung, Labor, EKG und Echokardiografie.
Das Beschwerdebild reicht von Brustschmerzen über Dyspnoe bis hin zu Arrhythmien oder Synkopen. Das EKG zeigt in den meisten Fällen diffuse ST-Hebungen oder T-Wellen-Anomalien. Bei einem Viertel der Patienten sieht man ventrikuläre Extrasystolen. Den Verdacht auf eine Myokarditis wecken v.a. polymorphe Extrasystolen. Überleitungsstörungen (z.B. ein AV-Block) weisen auf spezifische Formen hin, ein Linksschenkelblock kann Zeichen einer fulminanten Myokarditis sein. Unauffällig ist das EKG lediglich bei 15 % der Patienten mit Myokarditis. Über eine Echokardiografie lassen sich andere Ursachen rasch ausschließen.
In einem zweiten Schritt geht es darum, die Diagnose Myokarditis definitiv zu bestätigen. Dazu sollte man innerhalb von zwei Wochen nach Symptombeginn eine Endomyokardbiopsie oder eine Kardio-MRT veranlassen. Bioptisch finden sich bei Myokarditis entzündliche Infiltrate im Myokard mit degenerierten und nekrotischen Myozyten. In der MRT fällt zum einen eine regional oder global erhöhte T2-Signalintensität als Zeichen für ein myokardiales Ödem auf, zum anderen deutet das T1-Bild auf entzündungsbedingte Schäden hin. Bei Patienten mit kardiogenem Schock, komplizierter Myokarditis oder chronisch inflammatorischer Kardiomyopathie sollte frühzeitig die Biopsie angestrebt werden. Die Kardio-MRT ist erste Wahl bei unkomplizierter Myokarditis.
Immunphänotypen gewinnen an Relevanz
Die Analyse von spezifischen Immunphänotypen der Myokarditis wird in Zukunft an Bedeutung zunehmen, da sie prognostischen Charakter besitzen. Mittels einer kürzlich identifizierten Micro-RNA, die bei Myokardschäden von Th17-Zellen produziert wird, lässt sich eine Myokarditis mit großer Genauigkeit von einem Myokardinfarkt unterscheiden. Sie könnte zukünftig als Myokarditismarker dienen.
Das initiale klinische Bild ist entscheidend für die Prognose. Große Registerstudien haben gezeigt, dass Patienten mit fulminanter Myokarditis eine 30-Tage-Mortalität von rund 10 % haben. Patienten mit anfangs weniger fulminanter Myokarditis haben gute Chancen zu überleben. Zeichen für eine schlechte Prognose sind eine PRS-Prolongation über 120 ms oder Q-Wellen im EKG sowie eine linksventrikuläre Ejektionsfraktion < 50 % bei Aufnahme.
Der dritte Schritt der Evaluation umfasst weitere diagnostische Maßnahmen und dient der Weichenstellung für die Therapie. Nur Patienten mit unkomplizierter Myokarditis ohne besondere Risiken können eventuell ambulant behandelt werden. Grundsätzlich erfolgt die Therapie im Spital. Patienten mit fulminanter oder komplizierter Myokarditis sind intensivpflichtig.
Bei unkomplizierter Myokarditis und bestimmten Risikofaktoren (d.h. EKG-Veränderungen, cTnT > 50 ng/l, NYHA ≥ III) besteht ein erhöhtes Risiko für Arrhythmien. Die Betroffenen sind in einer Abteilung mit der Möglichkeit zur Telemetrie am besten aufgehoben.
Arrhythmie-Monitoring und Bildgebung in der Nachsorge
Sobald sich die Situation hämodynamisch stabilisiert hat, Arrhythmien kontrolliert sind und der Troponinwert auf ein normales Niveau gesunken ist, können die Patienten die Klinik verlassen. Auf Belastungstests vor der Entlassung sollte man verzichten. In mehr als 50 % der Fälle ist die Myokarditis nach zwei bis vier Wochen komplett verschwunden. Von den Patienten mit Hochrisikoprofil entwickelt jeder vierte eine persistierende linksventrikuläre Dysfunktion. In der Nachsorge sollten alle drei bis sechs Monate eine Bildgebung und ein Arrhythmie-Monitoring durchgeführt werden.
Martens P et al. J Am Heart Assoc 2023; 12: e031454; doi: 10.1161/JAHA.123.031454