Drum prüfe, wer ein Arzneimittel abgibt
 Zum Schutz vor Fälschungen müssen künftig alle rezeptpflichtigen Arzneimittel mit Sicherheitsmerkmalen versehen sein. Die Vorbereitung läuft auch Hochtouren. (Pharmaceutical Tribune 19/18)
Zum Schutz vor Fälschungen müssen künftig alle rezeptpflichtigen Arzneimittel mit Sicherheitsmerkmalen versehen sein. Die Vorbereitung läuft auch Hochtouren. (Pharmaceutical Tribune 19/18)
„Am 9. Februar 2019 tritt eine EU-Verordnung in Kraft, wonach alle jene verschreibungspflichtigen Arzneimittel, die die entsprechenden Sicherheitsmerkmale tragen, vor Abgabe an den Patienten verifiziert und auf ihre Echtheit geprüft werden müssen“, erklärte Dr. Wolfgang Andiel, Präsident des Österreichischen Generikaverbandes, zu Beginn seines Vortrages anlässlich einer Veranstaltung des Pharma Marketing Clubs (PMCA – siehe auch Seitenblick Seite 24). Alles, was davor für den Markt freigegeben wurde, muss diese Sicherheitsmerkmale noch nicht tragen, daher wird es eine relativ lange Übergangsfrist von bis zu fünf Jahren geben. Grundlage für die Verordnung ist die Arzneimittel-Fälschungs-Richtlinie der EU (2011/62/EU), wo die Einführung von Sicherheitsmerkmalen zur Überprüfung der Echtheit und Identifizierung der einzelnen Verpackungen sowie zum Schutz vor Manipulation der Außenverpackung vorgesehen ist.
Elektronische Erfassung
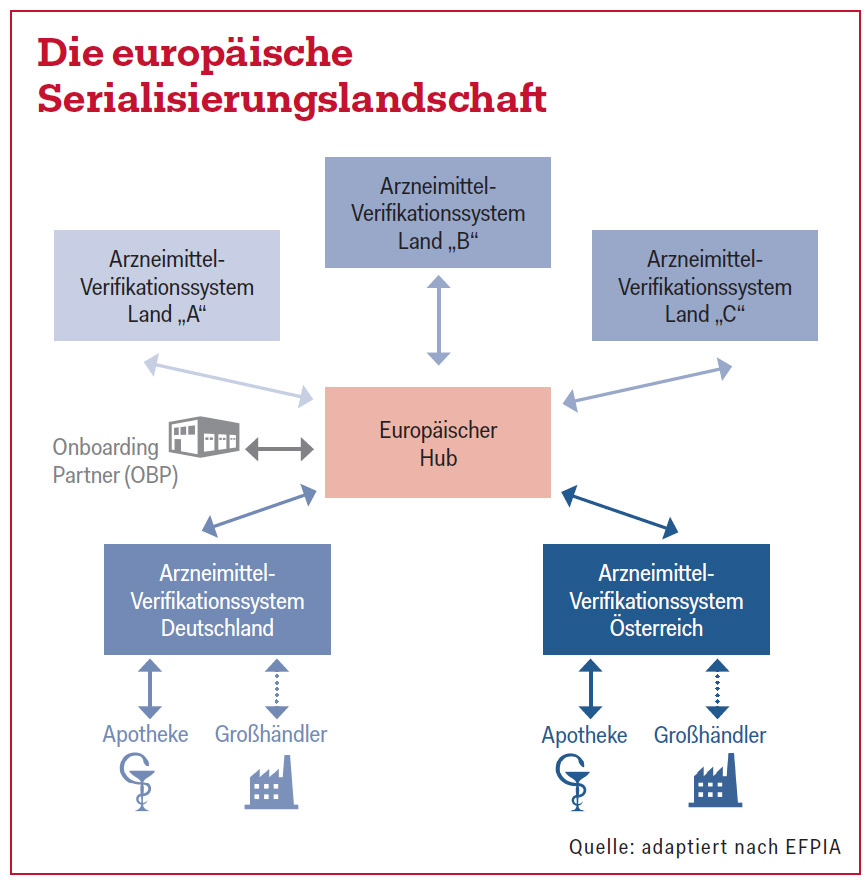
Die Umsetzung in Europa soll so erfolgen, dass einzelne Arzneimittel auf elektronischem Wege identifizierbar gemacht werden sollen. Hierfür speist der genannte „Onboarding Partner“, meist der Zulassungsinhaber oder der Hersteller des Arzneimittels, die individuellen Seriennummern in den „Europäischen Hub“ ein. „Dieser Hub ist das Verteilzentrum dieser Daten“, so Andiel. Die Serialisierung der Produktdaten ist länderspezifisch, im Europäischen Hub selbst werden keine Daten gespeichert, diese liegen in den jeweiligen nationalen Datenspeichersystemen. Andiel: „In der Apotheke werden diese Daten dann vor der Abgabe verifiziert und dekommissioniert, also aus dem System ausgebucht.“ Da laut EU-Verordnung ein nicht-gewinnorientierter Rechtsträger den Datenspeicher in dem jeweiligen Mitgliedsland errichten soll, wurde die Austrian Medicines Verification Organisation (AMVO) gegründet, die als Aufsichtsorgan fungiert.
Mit der Umsetzung ist ihre Tochterfirma, die Austrian Medicines Verification System GmbH (AMVS), betraut. Beteiligt sind die Pharmig, der Österreichische Generikaverband, der Verband der österreichischen Arzneimittelvollgroßhändler (PHAGO) sowie die Österreichische Ärztekammer und die Österreichische Apothekerkammer. „Die Finanzierung liegt zur Gänze bei der Industrie“, berichtete Andiel. Andere Stakeholder wie z.B. Großhandel oder Apothekerkammer sind berechtigt, an der Umsetzung teilzunehmen, müssen aber keine operativen Gebühren dafür zahlen. „Diese Stakeholder haben auch ihre Kosten, weil sie auf ihrer Seite Hard- und Softwarenachrüstungen vornehmen müssen“, so Andiel. Umgesetzt wird die Fälschungsschutzrichtlinie in 32 europäischen Ländern (28 EU-Länder, EFTA-Länder, Schweiz). Da sie bereits bestehende lokale Verifizierungssysteme haben, werden Griechenland und Italien die Richtlinie erst zu einem späteren Zeitpunkt umsetzen.
Auf Nummer sicher
Der Fälschungsschutz soll durch zwei individuelle Sicherheitsmerkmale sichergestellt werden: Ein 2D-Data-Matrix-Code, der alle relevanten Informationen enthält, wird direkt auf die Packung gedruckt, zusätzlich soll eine Vorrichtung gegen Manipulation zeigen, ob die Packung geöffnet oder verändert wurde. „Beides verlangsamt die Produktion, und das ist ein Teuerungsschritt, der oft bei der Kostenbetrachtung nicht berücksichtigt wird“, so Andiel. Der 2D-Data-Matrix-Code enthält den Produktcode (die bisherige EAN-13 Nummer mit vorgestellter Null), sowie eine Seriennummer, die Chargenbezeichnung und das Haltbarkeitsdatum. Andiel: „Verwechseln Sie das bitte nicht mit einem QR-Code.“ Alle Angaben des 2-D-Codes werden auch in menschlich lesbarer Form auf der Packung aufgedruckt. Serialisierungspflichtig sind alle rezeptpflichtigen Arzneimittel, die nicht in der sogenannten „Whitelist“ davon ausgenommen sind (z.B. Homöopathika, bestimmte radioaktive Arzneimittel etc.). Nicht serialisierungspflichtig sind alle rezeptfreien Arzneimittel, die nicht in die sogenannte Blacklist aufgenommen wurden (z.B. zwei Dosisstärken von Omeprazol). Derzeit läuft die Umsetzung auf Hochtouren. Andiel: „Wir sind in Österreich schon sehr weit, aber noch nicht dort, wo wir im Februar 2019 sein sollten.“
Auf einen Blick
- Betrifft Rx-Arzneimittel, die ab dem 9. Jänner 2019 für den Markt freigegeben werden (Ausnahmen Blacklist bzw. Whitelist).
- Übergangsfrist bis zu fünf Jahre, abhängig von der Chargenlaufzeit.
- End-to-end-Überprüfungssystem: Daten werden vom Onboarding-Partner eingespeist und in der Apotheke verifiziert und dekomissioniert.
- Zwei Sicherheitsmerkmale:
–2D-DataMatrix-Code als individuelles Erkennungsmerkmal: stellt sicher, dass das Arzneimittel vom rechtmäßigen Hersteller stammt.
–Vorrichtung gegen Manipulation: zeigt, ob die Packung geöffnet wurde. - Eingebunden in Errichtung und Umsetzung sind alle Teilnehmer der legalen Lieferkette.
- Serialisierungspflicht betrifft ca. 9.000 verschreibungspflichtige Arzneimittel und 150 Millionen Packungen pro Jahr.
