Europa in der Vorreiterrolle

Während in den USA lediglich 14 Biosimilars zugelassen sind, sind es in der EU über 50 Produkte. Unterschiede in der Wirkung habe man nicht zu befürchten, wurde bei einer Diskussion des Biosimilarsverbandes betont. (Pharmaceutical Tribune 1/19)
„Wenn Sie hören, das ist ein Biosimilar, können Sie davon ausgehen, dass es sich dabei um höchste geprüfte europäische Qualität handelt“, eröffnete Moderator Dr. Christoph Baumgärtel, BASG, die Diskussion. Univ.-Prof. Dr. Michael Freissmuth, Medizinische Universität Wien, betonte in Anspielung auf das 2006 zugelassene Somatropin-Präparat Omnitrope® (Sandoz): „Das erste Biosimilar stammte aus Österreich. Hier ist die EU ausnahmsweise ein Innovations-Leader gewesen, da sie diesen regulatorischen Pfad entwickelt hat.“
Biosimilar zu sich selbst
Die Herstellung von Biosimilars weist einige Tücken auf, wie Univ.- Prof. Dr. Andrea Laslop, BASG, in ihrer Keynote betonte. So gibt es auch bei Originalprodukten Unterschiede zwischen den einzelnen Chargen, die durch Änderungen im Herstellungsprozess bedingt sind. Laslop: „Ein Biosimilar ist auch eine neue Version dieses biologischen Produktes, mit dem Unterschied, dass der Herstellungsprozess grundsätzlich neu ist, weil es ja von einer anderen Firma hergestellt wird.“ Auch Freissmuth betonte, dass jedes biologisch hergestellte Arzneimittel ein Biosimilar zu sich selbst ist.
„Das Originalprodukt, mit dem die Zulassungsstudie gemacht wurde, ist biosimilar zum jetzt verkauften Produkt“, erklärte der Experte. „Es ist sogar gezeigt worden, dass die Batch-to-batch-Variation (Unterschiede zwischen den einzelnen Chargen, Anm.) bei Originalherstellern größer ist als die, die Sie bei Biosimilars finden.“ Befürchtungen, dass es bei biologisch bzw. biosimilar hergestellten Arzneimitteln Unterschiede in der Wirkung geben könnte, können allerdings zerstreut werden. Denn schon auf regulatorischer Ebene muss einerseits ein konsistenter Herstellungsprozess sowie die Biosimilarität des Produktes in physikochemischen und biologischen Eigenschaften nachgewiesen werden. Laslop: „Wenn wir uns sicher sind, dass ein Biosimilar ausreichend ähnlich ist zum Originalprodukt, dann gehen wir von regulatorischer Ebene davon aus, dass diese Biosimilars dazu geeignet sind, ausgetauscht zu werden, also dass sie so wie das Referenzprodukt bei einzelnen Patienten verwendet werden können.“
In der Praxis sind Ärzte oft mit anderen Problemstellungen konfrontiert als dem Unterschied zwischen Originalprodukt und Biosimilar, wie Prim. Univ.-Prof. Dr. Felix Keil, Hanusch-Krankenhaus, betonte. „Die Frage, die sich für mich stellt, ist: Dosieren wir die Patienten richtig? – Ich glaube nicht“, betonte der Hämatoonkologe. So bauen adipöse Patienten diese Arzneimittel schneller ab als schlanke; Frauen wiederum haben eine andere Clearance als Männer – das führt laut Keil dazu, dass die Arzneimittel oft anders dosiert werden müssen als in der Fachinformation angegeben. Für ihn wäre es daher wichtiger, diese Unterschiede genauer zu untersuchen und gegebenenfalls die Dosierungsempfehlungen anzupassen.
Faktor Kosten
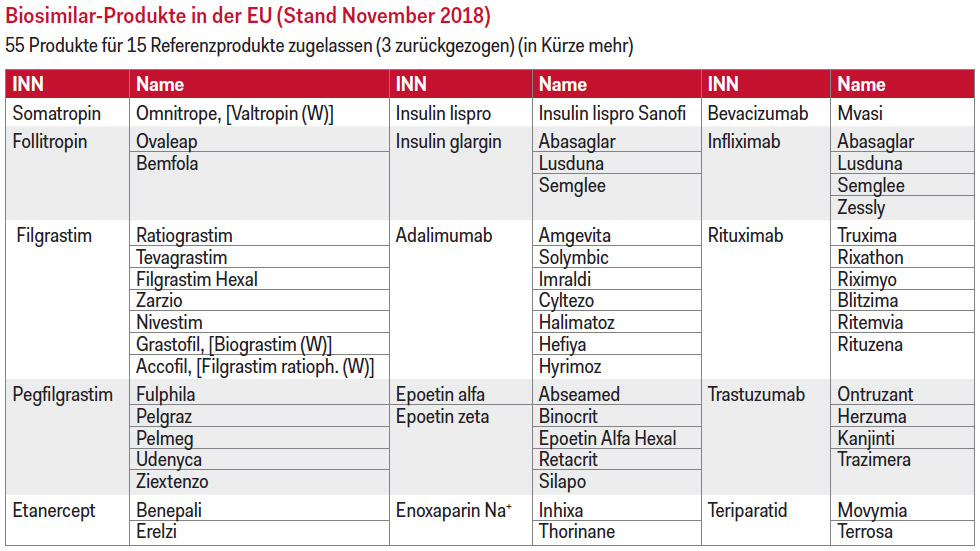
Derzeit sind in der EU (Stand November 2018 – siehe Tabelle) insgesamt 52 Biosimilars für 15 Referenzprodukte zugelassen. Hier habe Europa eine Vorreiterrolle, erklärte Dr. Sabine Möritz-Kaisergruber, Präsidentin des Biosimilarsverbandes Österreich. Sie verglich die europäischen Zahlen mit den USA, wo bisher nur 14 Biosimilars zugelassen wurden. Die Entwicklung eines Biosimilars koste lediglich „Peanuts“, wie Freissmuth betonte: „Das Teure sind die klinischen Studien.“ So schlägt die Entwicklung eines Biosimilars mit zirka 300 bis 600 Millionen Euro zu Buche. Dem steht bei einem Produkt wie z.B. Adalimumab ein Jahresumsatz von zehn Milliarden US-Dollar pro Jahr gegenüber. Worüber sich alle Beteiligten einig waren, ist, dass Biosimilars helfen, Geld zu sparen. Mag. Gernot Idinger, Leiter der Spitalsapotheke des KH Steyr, wies in einer Wortmeldung darauf hin, dass in „seinem“ Spital – trotz großer onkologischer Abteilung – die Patienten gut mit biologischen Arzneimitteln versorgt werden. Idinger: „Das Überraschende für mich war, dass wir ein gleich bleibendes Arzneimittelbudget haben, trotz des Einsatzes der Checkpoint-Inhibitoren“, berichtete Idlinger. „Das geht zum Großteil auf Biosimilars zurück, und das ist für mich ein großer Indikator, dass man ökonomisch sehr viel herausholen kann.“
Quelle: Podiumsdiskussion „Biosimilars auf dem Vormarsch“, Wien, 20. November 2018