Akutes und chronisches Nierenversagen
Akutes und chronisches Nierenversagen unterscheiden sich durch ihre Epidemiologie und ihre Ursachen. Gemeinsam sind ihnen aber erhebliche Auswirkungen auf die Morbidität und Mortalität der betroffenen Patientenkollektive. Eine chronische Nierenerkrankung birgt neben den renalen Komplikationen auch ein erhöhtes Risiko kardiovaskulärer Erkrankungen. Dabei ist die Mortalität schon bei leicht eingeschränkter Nierenfunktion erhöht und steigt stetig mit fortschreitender Nierenerkrankung.1 (CliniCum urologie 4/18)
Leichte Einschränkungen der Nierenfunktion sind meist symptomlos, und auch fortgeschrittene Schädigungen bleiben oft unentdeckt trotz erhöhter Mortalität. Dieser „silent killer“ chronische Nierenerkrankung betrifft zehn bis 14 Prozent der Bevölkerung.1 Die wichtigsten Risikofaktoren sind ebenfalls hochprävalent, in Österreich beispielsweise leiden 600.000 Menschen an Diabetes mellitus und zwei Millionen Menschen an arterieller Hypertonie.2,3
Akutes Nierenversagen/Nierenschädigung
Definition. Das akute Nierenversagen (ANV) ist gekennzeichnet durch eine rasche Verschlechterung der glomerulären Filtration mit oder ohne Reduktion der Harnmenge, was zur Retention harnpflichtiger Substanzen führt. Zur einheitlichen Definition und Graduierung wurde von der Kidney Disease: Improving Global Outcomes (KDIGO)-Arbeitsgruppe 2012 eine Einteilung verabschiedet, wobei auch der unklare Begriff des akuten Nierenversagens („acute renal failure“) durch den englischen Begriff „acute kidney injury“ (AKI)4 ersetzt wurde (siehe Tab. 1).
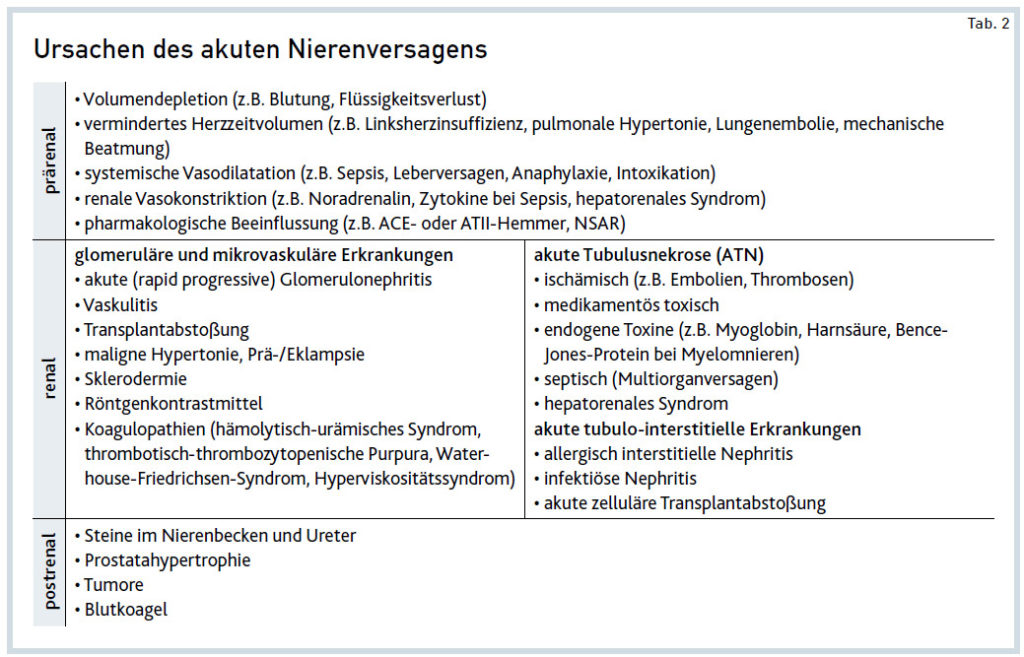
Epidemiologie und Ursachen. Die möglichen Auslöser einer akuten Verschlechterung werden je nach Ursprung in prärenal, renal und postrenal eingeteilt. Potenzielle Ursachen finden sich in Tab. 2. Mit einem Anteil von 50 bis 70 Prozent sind die meisten Fälle eines ANV unter ambulanten Patienten prärenal verursacht. Primär entsteht dabei kein renaler Schaden, sondern eine physiologische Gegenregulation der Nieren, sodass eine Remission möglich sein sollte. Erst bei prolongierter Minderperfusion kommt es zu Tubuluszellnekrosen und damit zum Übergang ins renale (intrinsische) Nierenversagen.
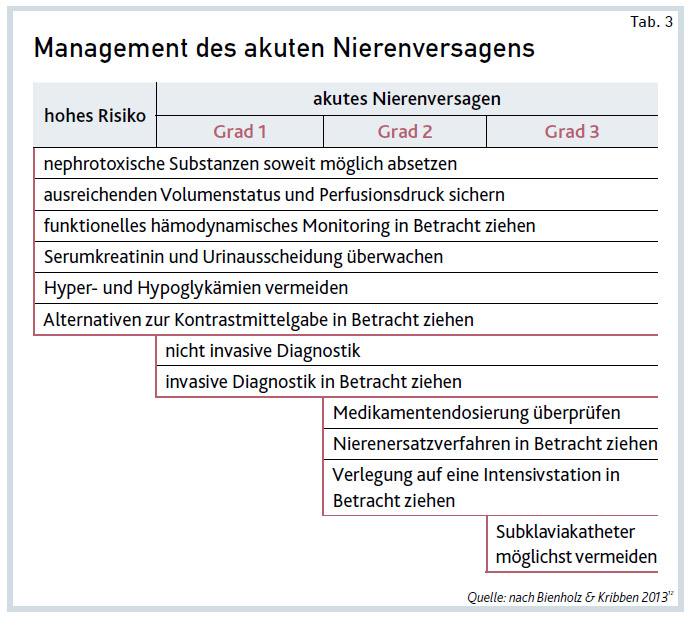
Management des ANV. Nach Möglichkeit sollten die Ursache für das ANV und das Stadium ermittelt werden. Es wird empfohlen, das Risiko eines Patienten anhand seiner individuellen Patientenmerkmale und der aktuellen Belastungen abzuschätzen. Je nach Stadium und Risiko sind verschiedene prophylaktische und therapeutische Maßnahmen in Betracht zu ziehen (siehe Tab. 3). Generell erfolgt die Therapie des ANV durch Beseitigung der auslösenden Noxen. Besonders bei prärenalen Ursachen sind die intravenöse Flüssigkeitsgabe sowie das Absetzen der antihypertensiven und diuretischen Medikamente und damit die Sicherstellung einer adäquaten Nierenperfusion maßgeblich.
Spezielle Empfehlungen betreffen die Erhöhung des intravaskulären Volumens. Bei erhöhtem Risiko oder manifestem ANV ohne Blutung wird die Verwendung isotonischer kristalloider Lösungen anstelle von kolloidalen Lösungen (Albumin oder Stärke) angeraten. Besteht bei Patienten mit Schock und Vasomotorenkollaps erhöhtes Risiko oder bereits ein manifestes ANV, empfiehlt sich die Verwendung von Vasopressoren in Verbindung mit Flüssigkeit (siehe Tab. 3). Norepinephrin gilt hier als First-line-Therapie im Gegensatz zu Dopamin.5 Zur Vermeidung einer Stress-Hyperglykämie wird bei kritisch kranken Patienten eine Insulintherapie mit einem Zielwert von 110–149mg/dl Plasmaglukose vorgeschlagen.
Ergänzend soll eine Energiezufuhr von 20–30kcal/kg KG/Tag bei Patienten mit jeglichem Schweregrad eines ANV sichergestellt werden, wobei auf eine Proteinrestriktion verzichtet werden kann. Nichtkatabole Patienten mit ANV ohne Dialysetherapie sollten 0,8–1,0g/kg KG/Tag Protein erhalten, solche mit Nierenersatztherapie 1,0–1,5g/kg KG/Tag. Bei Patienten mit kontinuierlicher Nierenersatztherapie sowie bei Patienten mit Hyperkatabolie werden 1,7g/kg KG/Tag Protein empfohlen. Generell wird eine enterale Ernährung bevorzugt. Diuretika verbessern die Prognose nicht und sind nur bei manifester Überwässerung indiziert.
Monitoring. Die auch noch in der Kidney Disease Outcomes Quality Initiative (KDOQI) angeführten Befürchtungen zum Kontrastmittel-induzierten Nierenversagen dürften sich durch rezente Publikationen relativieren lassen.6-8 Bei Patienten mit erhöhtem Risiko für ANV und bei manifester Erkrankung sollte das regelmäßige Monitoring mittels Serumkreatinin und Urinausscheidung erfolgen. Nachdem ein ANV oft mit Folgeschäden abheilt bzw. ohnedies oft auf Basis einer renalen Vorschädigung entstanden ist, sollten Patienten drei Monate nach seinem Beginn bezüglich einer Remission, eines Neuauftretens einer chronischen Nierenerkrankung oder einer Progression einer vorbestehenden chronischen Nierenerkrankung evaluiert werden.
Chronisches Nierenversagen
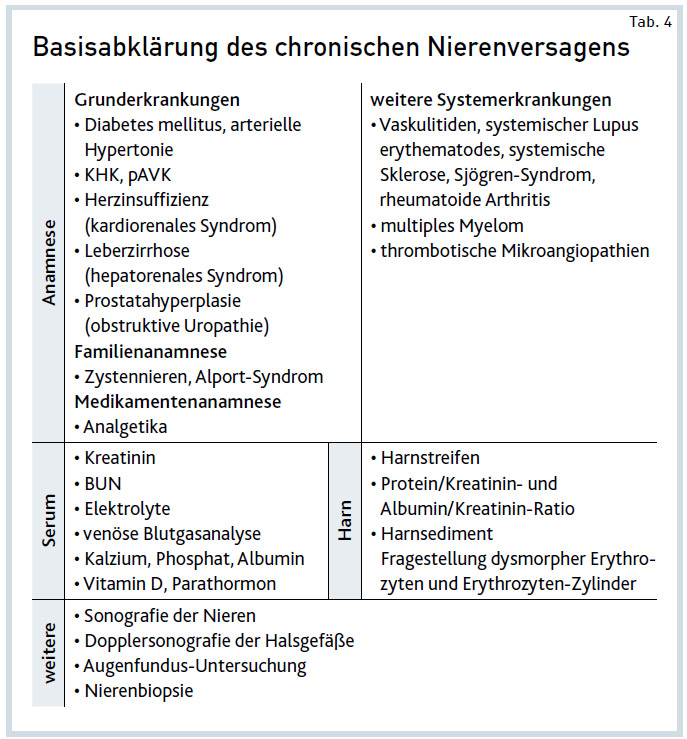
Definition. Eine chronische Nierenerkrankung besteht bei länger als drei Monaten bestehender Nierenbeeinträchtigung.1 Funktionelle Beeinträchtigungen wären eine reduzierte glomeruläre Filtrationsrate (GFR; gemessen in ml/min) oder chemische Auffälligkeiten des Urins wie Proteinurie oder glomeruläre Hämaturie. Pathologien der Form wären etwa Zystennieren oder Schrumpfnieren. Die Erhebung laborchemischer und morphologischer Parameter sowie eine ausführliche Anamnese sind somit erforderlich zur Basisabklärung hinsichtlich Genese und Stadium eines suspizierten chronischen Nierenversagens – Tab. 4 zeigt die erforderlichen Untersuchungen im Überblick.
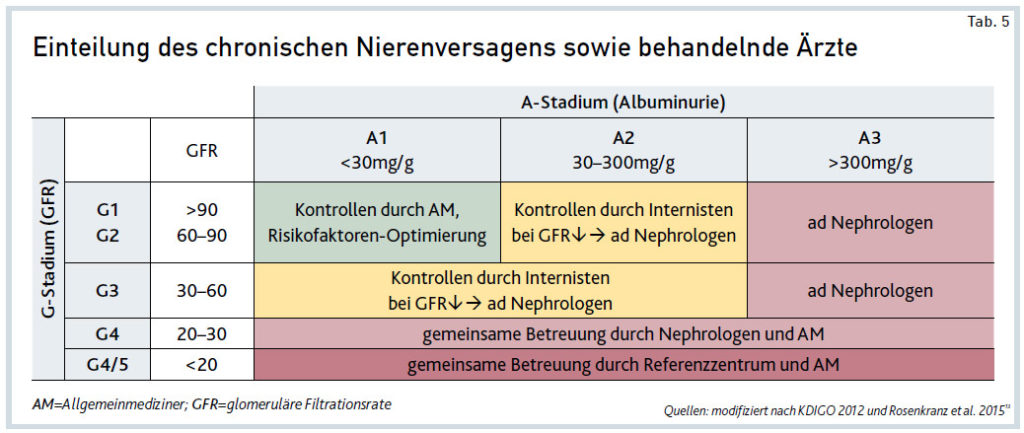
Analog zum ANV empfiehlt die KDIGO-Arbeitsgruppe eine Einteilung des chronischen Nierenversagens (CNV) oder englisch „chronic kidney disease“ (CKD) in verschiedene Stadien.1 Die KDIGO/CKD-Einteilung erfolgt anhand der GFR sowie der Albuminurie. Das Ausmaß der Albuminurie im Spontanharn ist ein einfach zu erhebender Parameter, der eine Einschätzung des Progressionsrisikos hin zu einer fortgeschrittenen Niereneinschränkung ermöglicht. Je nach Stadium bzw. Progressionsrisiko sind unterschiedliche medizinische Fachrichtungen in die Betreuung dieser Patienten miteinzubeziehen (siehe Tab. 5).
Ursachen. Die zugrunde liegende Ursache ist ein weiteres Kriterium zur Einteilung des CNV. Es dominieren chronische diabetische sowie vaskuläre Nierenschädigungen. In Österreich leiden 45,8 Prozent der dialysepflichtigen Patienten an einer diabetischen oder vaskulären Nephropathie.9
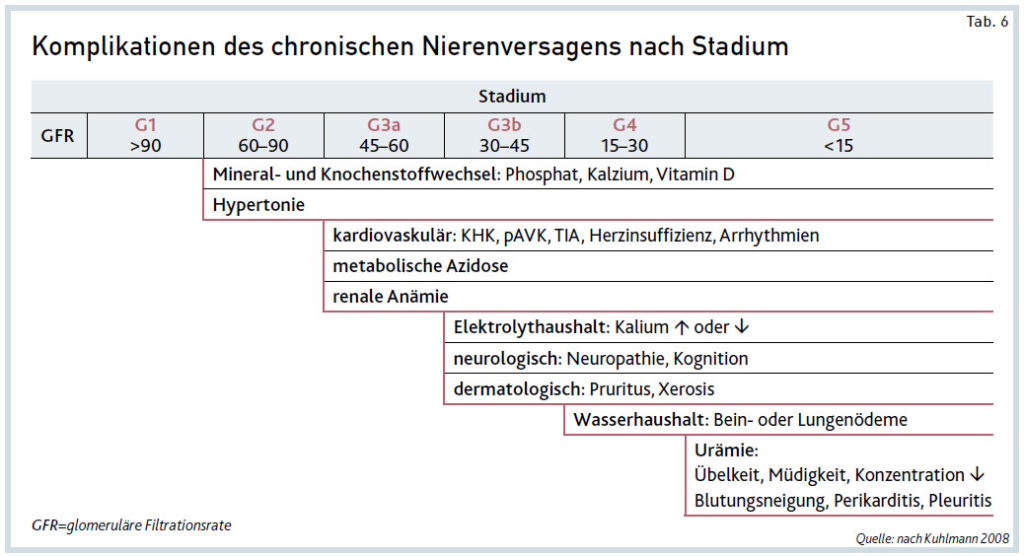
Komplikationen. Die Stadieneinteilung des CNV erfolgt anhand der GFR. Eine Einteilung primär nach exkretorischer Funktion ist sinnvoll, da diese technisch einfach zu erhebende Zahl eine Abschätzung der anderen endokrinen und metabolischen Komplikationen des CNV erlaubt (siehe Tab. 6).10 Hypertonie stellt sich frühzeitig im Verlauf ein, in einer amerikanischen Studie fanden sich beispielsweise im Stadium 3 bzw. 4 ein arterieller Hypertonus bei 75 bzw. 78 Prozent der Patienten.11 Metabolische Störungen treten ab dem Stadium 3 (GFR <60ml/min) auf, bei 90 Prozent der Patienten im Stadium 5 besteht eine metabole Azidose. Durch den fortgeschrittenen Verlust funktionstüchtiger Nephrone stellt sich eine Beeinträchtigung der Exkretion von Säureäquivalenten wie Ammonium und später Phosphat sowie der Rückresorption von Bicarbonat ein und führt somit zur Azidose. Klinisch auffällig ist hier allenfalls eine gesteigerte Atemfrequenz, eine Azidose hat jedoch multiple extrarenale Auswirkungen, z.B. katabolen Muskelstoffwechsel, und führt zu erhöhter Mortalität.
Weitere Störungen des Wasser- und Elektrolythaushaltes können sich ab dem Stadium 4 (GFR <30ml/min) einstellen. Klinische und laborchemische Manifestationen sind hier Ödeme der Beine und Lunge sowie Hyperkaliämien. Je nach Ursache des CNV entwickelt sich auch eine renal bedingte Anämie. Bei Patienten mit Zystennieren beispielsweise kann diese Komplikation komplett ausbleiben, bei diabetischer Nephropathie oder interstitiellen Nephritiden tritt sie früher ein. Insgesamt präsentiert sich u.a. aufgrund eines gestörten Eisenmetabolismus die renale Anämie oft laborchemisch als Eisenmangelanämie. Eisensubstitution und Erythropoietin-Gabe sollten ab dem Stadium 4 (GFR <30ml/min) und einem Serum-Hämoglobinwert von >9–10g/dl erfolgen.
Management des CNV. Je nach Ursache besteht die Therapie in der Kontrolle der Grunderkrankung. Bei diabetischer bzw. hypertensiver Genese vermindert eine adäquate Blutzucker- und Blutdruckeinstellung das Progressionsrisiko der Nierenerkrankung. Ebenso notwendig ist die nephrologisch geführte Therapie der eben beschriebenen Komplikationen, die an Zahl und Komplexität mit Fortschreiten der Nierenerkrankung zunehmen (siehe Tab. 5 und 6).
Indikationen zur Nierenersatztherapie. Bei Fortschreiten des CNV stellen sich im Stadium 5 (GFR <15ml/min) Überwässerung sowie Entgleisungen des Blutdrucks, der Elektrolyte und des Säure-Basen-Haushalts ein, die medikamentös nicht mehr zu beherrschen sind. Zusätzlich kommt es durch Akkumulation urämischer Toxine klinisch zu Abgeschlagenheit, Appetitlosigkeit, Juckreiz, Perikarditis und Pleuritis. Diese Beschwerden sind ab einer GFR 5–10ml/min zu erwarten, stellen sich jedoch je nach Patient früher oder später ein, und dementsprechend sollte der Beginn einer Nierenersatztherapie individuell entschieden werden. Es bestehen jedoch Akutindikationen: Bei Perikarditis, Pleuritis, Blutungen oder rasch progredienter urämischer Enzephalopathie muss der Patient unmittelbar dialysiert werden.1
Nierentransplantation & Nierenersatzverfahren
Bei Patienten mit CNV im Endstadium („end-stage renal disease“, ESRD) bestehen drei Möglichkeiten, die ab dem Stadium 3 (GFR <30ml/min) erwogen und vorbereitet werden: Nierentransplantation und extrakorporale Verfahren wie Peritonealdialyse und Hämodialyse. Eine zusätzliche vierte Möglichkeit des bewussten Verzichts auf Dialyse und Transplantation kann bei bestimmten multimorbiden Patienten erwogen werden. In Österreich waren 2016 insgesamt 4.500 Patienten dialysepflichtig, davon wurden 4.111 Patienten an der chronischen Hämodialyse und 389 Patienten mit Peritonealdialyse behandelt.9 Jedes Jahr werden 900–1.100 Patienten neu dialysepflichtig, wobei jüngere Patienten öfter ein Nierentransplantat erhalten als Patienten älter als 65 Jahre. In den Daten des Österreichischen Dialyse- und Transplantationsregisters (ÖDTR) lässt sich jedoch eine unlängst stattgefundene Trendwende hin zur Nierentransplantation auch älterer Patienten erkennen.9
Nierentransplantation. Im Vorfeld einer möglichen Nierentransplantation steht eine umfassende Evaluierung des Patienten. Da eine chronische Immunsuppression zur Verhinderung einer Abstoßungsreaktion notwendig ist, stellen beispielsweise akute Infektionen oder maligne Erkrankungen absolute oder relative Kontraindikationen dar, je nachdem, ob das Problem nach Behandlung und entsprechender Beobachtungszeit beseitigt werden konnte. Komorbiditäten sowie eine eingeschränkte Lebenserwartung post Transplantation werden je nach Transplantationszentrum ebenfalls zur Entscheidungsfindung herangezogen. Vaskulitiden oder Amyloidose stellen relative Kontraindikationen dar und werden individuell evaluiert.
Peritonealdialyse. Diese ist ein alternatives Nierenersatzverfahren. Es bestehen nur wenige absolute Kontraindikationen, diese Art der Therapie erfolgt jedoch großteils durch den Patienten selbst und erfordert daher ein hohes Maß an Compliance und Eigenverantwortung. Technische Voraussetzung ist die Anlage eines Katheters, mittels dessen Dialysat in die Bauchhöhle eingebracht und regelmäßig gewechselt wird. Die Dialysat-Wechsel erfolgen entweder untertags durch den Patienten selbst („continuous ambulatory peritoneal dialysis“, CAPD) oder nachts durch einen automatischen Cycler („automated peritoneal dialysis“, APD). Die regelmäßigen Dialysat-Wechsel, aber auch der Kathetertunnel stellen Infektionsquellen dar, eine Peritonitis ist daher eine gefürchtete Komplikation der Peritonealdialyse. Die chemische Beanspruchung des Peritoneums bei diesem Verfahren führt naturgemäß dazu, dass nach einigen Jahren zur Hämodialyse gewechselt werden muss.
Hämodialyse. Umgangssprachlich wird das Verfahren als „Hämodialyse“ bezeichnet, genau genommen finden hier jedoch zwei Vorgänge statt: Dialyse und Ultrafiltration. Während derselben Sitzung werden gleichzeitig Toxine wie Harnstoff osmotisch in ein Dialysat übergeleitet (Hämodialyse) und dem Kreislauf Wasser entzogen (Hämofiltration). Chronische Hämodialyse findet meist dreimal pro Woche in Sitzungen zu jeweils vier bis fünf Stunden in einem Dialysezentrum statt. Technische Voraussetzung ist die Anlage eines vaskulären Zugangs, durch den sich die erforderten hohen Blutflussraten erreichen lassen. Im Idealfall wurde dem Patienten bereits Monate vor Progression zu einer dialysepflichtigen Niereninsuffizienz ein arteriovenöser Shunt am Unter- oder Oberarm angelegt. Nach Anlage vergehen jedoch im Rahmen der sogenannten „Shunt-Reifung“ einige Wochen, bis sich die arteriovenöse Fistel entsprechend dimensioniert hat und hohe Blutflüsse möglich sind. Alternativ und unmittelbar zur Hämodialyse benutzbar kann ein untertunnelter Katheter der Vena jugularis interna („PermKath™“) angelegt und bis zu einem Jahr genutzt werden. Bei Shuntthrombose oder auch zur Akutdialyse kann alternativ ein groß- und doppellumiger zentralvenöser Katheter, vorzugsweise an der Vena jugularis interna, angelegt und kurzfristig genutzt werden.
Conservative Care. In schwerkranken bzw. geriatrischen Patientenkollektiven sollte auch eine konservative symptomatische und medikamentöse Therapie ohne Dialyse in Betracht gezogen werden. Dies betrifft v.a. Patienten in kritisch krankem Zustand, deren bereits reduzierte Lebensqualität durch häufige Transporte und Hospitalisierungen weiter eingeschränkt werden würden. Weiters bestehen geriatrische Syndrome mit Überlappung zu urämischen Syndromen sowie Patienten mit sehr langsamer Progressionsrate bei akzeptabler Residualfunktion. Insgesamt sollte die Dialyse nur dann eingeleitet werden, wenn die Belastung durch die Behandlung den Leidensdruck der Erkrankung nicht übersteigt.
Zusammenfassung
Akutes und chronisches Nierenversagen haben beide erhebliche Auswirkungen auf die Lebenserwartung Betroffener, die sich nicht nur aus der renalen Funktionsstörung, sondern aus den beschriebenen Komorbiditäten ergeben. Nachdem die renalen Funktionsstörungen erst im weit fortgeschrittenen Stadium symptomatisch werden, kann das Ausmaß der Erkrankung lange unterschätzt werden. Die vielfältigen Begleiterkrankungen im Rahmen der Urämie und v.a. nach Nierentransplantation verlangen eine interdisziplinäre Zusammenarbeit der verschiedensten medizinischen Fachrichtungen und eine Einbeziehung von spezialisierten Pflegekräften, Diätologen und physikalischen Therapeuten zur Betreuung dieses komplexen Patientenkollektivs.
Referenzen:
1 KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International Supplements 2013; Vol 3, Issue 1;
2 Chronische Krankheiten und Gesundheitsprobleme 2014; Statistik Austria 2015 (accessed: 5 Oct 2018);
3 Österreichische Diabetes Gesellschaft (ÖDG): Face Diabetes – Zahlen und Fakten. (accessed: 5 Oct 2018);
4 Khwaja A: KDIGO clinical practice guidelines for acute kidney injury. Nephron Clinical Practice 2012; 120:c179–84;
5 Palevsky PM et al.: KDOQI US commentary on the 2012 KDIGO clinical practice guideline for acute kidney injury. Am J Kidney Dis 2013; 61:649–72;
6 Weisbord SD et al.: Outcomes after Angiography with Sodium Bicarbonate and Acetylcysteine. NEJM 2018; 378:603–14;
7 Hinson JS et al.: Risk of Acute Kidney Injury After Intravenous Contrast Media Administration. Annals of Emergency Medicine 2017; 69:577–86.e4;
8 Nijssen EC et al.: Prophylactic hydration to protect renal function from intravascular iodinated contrast material in patients at high risk of contrast-induced nephropathy (AMACING): a prospective, randomised, phase 3, controlled, open-label, noninferiority trial. Lancet 2017; 389:1312–22;
9 ARGE Österreichisches Dialyse- und Transplantationsregister 2017. Österreichisches Dialyse- und Transplantationsregister Nierenersatztherapie in Österreich. Jahresbericht 2016. https://www.nephro.at/oedr2016/oedr2016.htm (accessed: 29 Sept 2018);
10 Kuhlmann U: Nephrologie: Pathophysiologie-Klinik- Nierenersatzverfahren. Georg Thieme Verlag 2008;
11 Collins AJ et al.: 2013 USRDS Annual Data Report: Atlas of chronic kidney disease and end-stage renal disease in the United States. 2014; 63:e1–e478:
12 Bienholz A, Kribben A: KDIGO-Leitlinien zum akuten Nierenversagen. Der Nephrologe 2013; 8:247–51;
13 Rosenkranz A, Krisper P, Eller K: Chronische Niereninsuffizienz. Österreichische Ärztezeitung 2015